| |
Konventionelle Messtechnik: |
  |
- Worin besteht pH Messtechnik?
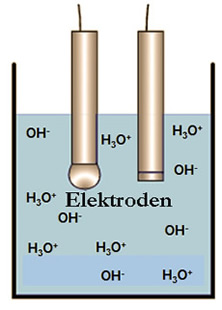
- In Wasser sind 2 * 10-7 mol / Liter der vorhandenen Wassermoleküle in Ionen dissoziiert
- Bei pH 7 (neutrale Flüssigkeit) sind diese Ionen zu gleichen Teilen enthalten als:
- Die pH Wert Bestimmung geschieht über die Anzahl von H+ Ionen die sich an der Glasmembran anlagern
- Der pH Wert ist definiert als negativer Logarithmus der H3O+ Ionen
- In neutraler Lösung bei gleicher Anzahl von Ionen ist das Ergebnis
- pH = - log (1 * 10-7] = 7
- Säuren oder Laugen verändern, wenn sie in Wasser gelöst werden die relative Anzahl von H+ oder OH- Ionen und damit den pH Wert
|
| |
Glasmembran: |
 |
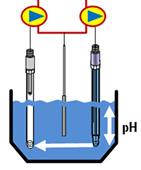
- Die meisten konventionellen pH- Messungen bestehen aus einer
Glas- Mess- und einer Referenzelektrode
- Zur pH Messung werden die Spannungen der Mess- und der Referenzelektrode miteinander verglichen
- Die von der Referenz erzeugte Spannung ist im Idealfall immer konstant
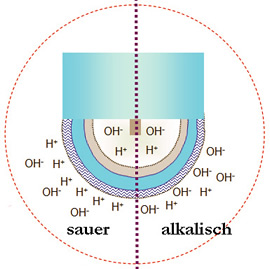
- In sauren Lösungen lagern sich H+ Ionen an der pH Sensitiven Glasmembran an
- In alkalischen Lösungen sind OH- Ionen an der Membran in der Überzahl
- Die Referenz- Seite der Messung ist immer problematisch weil diese gegenüber der zu messenden Prozesslösung praktisch eine offene Verbindung darstellt und weil Fremdionen in diese Öffnung eindringen können. s.unten.
- Um eine gut funktionierende Messung zu erreichen ist immerwährende Pflege erforderlich und somit ein hoher Wartungsaufwand vornehmlich zur Reinigung der Elektroden und gelegentlich zur Kalibrierung mit Pufferlösungen
|
| |
Potentiale: |
 |
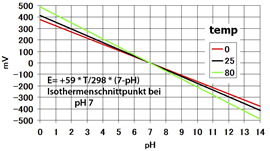
- Zwischen der Membran (mit Ionen- Überschuss in der einen oder der anderen Richtung) und dem Innenpuffer (pH7) bildet sich ein elektrisches Potential aus von 59,16 mV / pH bei 25 °C
- Im sauren Bereich hat die Spannung ein positives Vorzeichen
- Im alkalischen Bereich hat die Spannung ein negatives Vorzeichen
- Die Steigung ist abhängig von der Temperatur
- Alle Lösungen im Inneren der Elektroden haben üblicherweise pH 7 und müssen eine konstante Salzkonzentration aufweisen
- Die Spannung der Referenzelektrode darf sich nicht ändern mit dem pH der Prozesslösung.
Anionen die Salze bilden mit Silber Bromide, Jodite, Sulphite) müssen Außerhalb der Elektrode gehalten
- Das Diaphragma muss unter allen Bedingungen sauber bleiben
- Eine saubere Glasmembran bringt eine hohe Steilheit, deren chemische Beständigkeit ergibt eine hohe Stabilität des inneren pH Wertes (pH2)
|
| |
Messkreis: |
 |
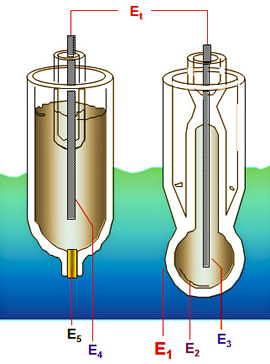
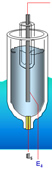
- Potentiale im pH Messkreis:
- Et: = pH Spannung zum Messumformer
Differenz der Spannungen der Referenzseite (E4,E5) und der Messseite (E1, E2, E3)
- E1: zwischen pH Glas und Prozessflüssigkeit
- E2: zwischen pH Glas und Elektrolyt im Inneren des Sensors
- E3: zwischen Mess Elektrodenstift und Elektrolyt
- E4: zwischen Referenz Elektrodenstift und Elektrolyt
- E5: zwischen Elektrolyt und Prozess als Diffusionspotential über dem Diaphragma der Referenz, soll 0 mV betragen.
- E3 und E4 sind gleich groß und entgegengesetzt; diese Potentiale heben sich auf bei gleichem chemischen Innen- Aufbau der Elektroden
Unsymmetrische Potentiale werden auskalibriert.
- E1 und E2 bilden den pH Wert an der Messelektrode als Differenz zwischen den pH Werten der Messlösung und dem inneren Elektrolyten
Δ E1,2 = 59 (pH2 - pH1)
|
| |
Referenz- Seite: |
 |
- Typischerweise ist die Referenz ein Metalldraht, der zusammen mit seinem unlöslichen Metall-Salz in einer Elektrolytlösung in Gel oder Flüssig-Form untergebracht ist
- Diese Referenzkonstruktion ist von der Prozessflüssigkeit durch eine poröse Verbindung getrennt
- Der Zweck der Referenzelektrode ist es, ein stabiles Spannungssignal zu liefern gegen welches der pH Wert der Glaselektrode gemessen werden kann.
- Das Innere der Referenz darf von der Prozessflüssigkeit nicht beeinträchtigt werden.
- Ein großer Vorrat bringt lange Standzeiten
- Die Referenzelektrode ist empfindlich gegen Faulen / Vergiften, d.h. Verunreinigung der Innenlösung (KCL) durch Fremdionen
Dadurch wird die Messung träge und ungenau
- Sie ist ebenso empfindlich gegen Verblockung des Kontaktes zwischen Silberdraht und Messlösung indem das Diaphragma von außen verstopft wird. Die Referenzspannung ist dann ungenau und instabil
- Die Verblockung wird erschwert indem man Diaphragmen verwendet aus Keramik oder PTFE, verbunden mit einem höheren Innendruck oder als ausfließende Elektrode mit einem eingebauten Reservoir an KCL- Referenzflüssigkeit, welche diese Verbindung zum Prozess frei spült
- Es gibt auch Konzepte, die ganz ohne offene Verbindung auskommen wobei die Referenz genau wie die Messseite ganz aus einer Glasmembran besteht. Siehe unten.
|
| |
Spannung an einer Standard- Referenz- Elektrode in mV: |
  |
Temperatur |
AgCl gesättigt
|
AgCl 3mol |
AgCl 1mol |
Kalomel |
| 0 °C |
221 |
224 |
252 |
260 |
| 10 °C |
212 |
217 |
246 |
254 |
| 20 °C |
202 |
211 |
240 |
248 |
| 30 °C |
192 |
203 |
233 |
241 |
| 40 °C |
181 |
196 |
226 |
234 |
| 50 °C |
171 |
188 |
219 |
227 |
| Kombi- Elektrode ohne Diaphragma mit Natrium Glas- Referenz: |
 |
- Die Referenzspannung der Natrium Referenzelektrode wird von der Prozessflüssigkeit bestimmt; sie ist damit vollständig abhängig vom Gehalt aller Salze im Prozess
- Die Referenzspannung ändert sich, wenn sich die Salzkonzentration ändert
- Schwankungen der Salzkonzentration um +- 25 % bewirken allerdings nur einen maximalen pH Messfehler von 0,2 pH
- Prozesse mit einer Natriumkonzentration > 5 g / l liefern eine stabile Nullpunkt Kalibrierung
- Prozesse mit weniger als 5 g / l Natrium aber mit stabiler Konzentration verursachen keine pH Wert Änderung auf Grund der Referenz; der Offset des Nullpunktes kann mit einer Einpunkt- Kalibrierung korrigiert werden
- Der Sensor ist bestens geeignet für pH Regelungen
- Er wird mit einer Stichprobe aus dem Prozess kalibriert
- Die bestimmenden Kriterien dieser Applikationen:
- Wie hoch ist die Natrium Konzentration?
- Ist diese stabil oder schwankt sie?
- Wie ist der gewünschte pH Messbereich?
- Vorteile sind:
- Keine Probleme mehr mit:
- Vergiftung
- Verstopfung
- Elektrolytmangel
- Reduzierte Wartung
- gesteigerte Zuverlässigkeit der Messung
- Die einzig notwendige Pflege: Reinigen
- Spezielle Pufferlösungen verfügbar zur Kalibrierung
|
| |
Glas- Aufbau / Eigenschaften : |
 |
- Die Glas- und Referenzelektrode wird in einem gemeinsamen Sensor zusammengefasst
- Die Referenz (gelb) besteht ebenfalls wie die Messelektrode aus Glas
- Die Referenzspannung ist sehr stabil ab 2 pH in einer 1 mol/l Salzlösung
- Der Sensor ist deshalb spezifiziert von 2 bis 14 pH
- Indirekte pH Messung, die eine stabile Natriumkonzentration im Prozess erfordert
- Eigenschaften: Sterilisierbarer pH Sensor, Praktisch Wartungsfrei, Kein Diaphragma, keine Diffusion hohe Stabilität, verschiedene Schaftlängen
- Eingebauter Redox- Stift, gleichzeitig Erdung für den Messumformer
- Anwendungen: Fermentationsprozesse, Gaswäscher, Chlorelektrolyse, Elektrolyse von Salzlösungen, Prozesse in denen KCL verboten ist, Bei schnellen Temperatur- und Druckschwankungen, Bio- Ethanolprozesse, Papier- und Zellstoffindustrie
- Bestens geeignet für pH- Regelungen
- Spezifikationen: pH 2…14, Einsetzbar bei stabiler Salzkonzentration, eingebauter Temperatursensor, VP Stecksystem
- Redox Sensor integriert
|
| |
mV Spannung des Differenz pH Sensors: |
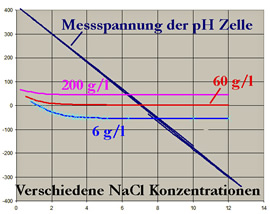 |
- mV Spannung der Glaselektrode: Blaue Linie
- mV Spannung der Referenz gemessen bei verschiedenen NaCL Konzentrationen:
- rosa: 200 g/l: Spannung linear zwischen 2 und 12 pH
- rot: 60 g/l: Spannung linear zwischen ca 3 und 12 pH
- blau: 6 g/l: Spannung linear zwischen ca 4 und 12 pH
- Die Elektrode ohne Diaphragma hat ein Asymmetriepotential abhängig von der Salzkonzentration. Korrektur mit einfacher Prozesskalibration
- Die Elektrode hat einen "Säurefehler" unterhalb 2 pH
- In Prozessen mit mehr als 6 g/l NaCl ist die Drift geringer als 0,2 pH; der Nullpunkt ist mittels Prozesskalibration stabil zu ermitteln
- Prozesse mit weniger als 6 g/l NaCl können dann gemessen werden, wenn die NaCl Konzentration konstant ist, ds der Offset ebenfalls kalibriert werden kann
|











